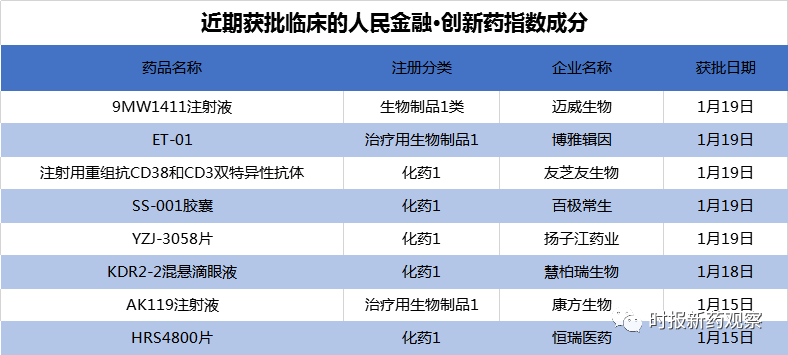
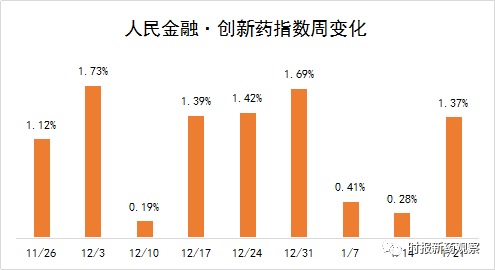
截至1月21日,“人民金融·创新药指数”报1352.9点,在最近一个发布周期内上涨了1.37%,反映出最近我国创新药研发势头良好。在1月15日至1月21日的发布周期内,来自博雅辑因、康方生物、恒瑞医药等的创新药获批临床,我们将其纳入了“人民金融·创新药指数”。目前,“人民金融·创新药指数”的成分样本共有716个。
新冠检测需研究综合检测方案
春节在即,随着人员流动大幅增加,疫情防控将更加严峻和复杂。
1月19日,国家卫健委发布了《冬春季农村地区新冠肺炎疫情防控工作方案》的通知,对农村地区及返乡人员相关防疫工作进行部署。方案指出,返乡人员需持7天内有效新冠病毒核酸检测阴性结果返乡,返乡后实行14天居家健康监测,期间不聚集、不流动,每7天开展一次核酸检测。受新规利好刺激,今日新冠检测板块大涨,凯普生物、迪安诊断、华大基因等大涨超10%。
我国新冠检测的金标准是核酸检测,不过从案例来看,核酸检测并不能完全及时发现病例。
比如,1月19日石家庄新增的13例新冠肺炎确诊病例中,有多人是核酸检测8次或9次才最终确诊。1月16日,北京市第211场新冠肺炎疫情防控新闻发布会介绍,北京一确诊病例第7次核酸检测为阳性。前段时间,大连有的病例做了11次核酸检测才显出阳性,有的地区检测6轮还有阳性病例出现。因此,如何提升检测能力需要好好研究。
核酸检测能在感染新冠病毒的3-7天检测出来,但在感染7天之后随着病毒从鼻咽部下沉,检出率下降,漏检率提高。同时,核酸试剂是用鼻拭子或咽拭子取样,取样不当也会导致检测不出新冠病毒。所以,大连有的病例做了11次核酸检测才显出阳性,既有潜伏期长的可能,也有取样不当及试剂存在问题的可能;而有的地区检测6轮还有阳性病例出现,很有可能是有病例漏检了并传染给了别人。
目前,新冠检测有核酸、抗体、抗原三种试剂,各有特点。抗体试剂的特点是感染7-10天左右时检出率最高,但不能判断是新感染者还是曾经的感染者。抗原试剂的特点是,在感染新冠病毒后1至15天内的检出率较高,操作简便,不需要专用仪器,现场就能即时检测,从提取鼻拭子样本到检测结果,最快只需要2分钟,一般在15分钟之内,适合大规模筛查。因此,有专家提出以核酸、抗体、抗原三种试剂联合使用应对当前严峻、复杂的疫情。
核酸和抗体试剂的联合使用,可在一定程度上解决感染7天之后的漏检问题,核酸和抗原试剂的联合使用可提高大规模筛查的效率。若抗原试剂针对普通人群使用,可提高复工、复学和旅游、商务活动的效率。2020年10月份以来,美、英、法、德等国家将抗原试剂作为复工复学,机场、车站等人流密集场所,发热门诊筛查新冠感染者的主要手段,取得了较好的效果。
新冠病毒检测三类试剂中,抗原试剂的优势明显,但我国已批准的抗原试剂准确率不高。2020年11月3日,国家药监局应急审批通过了两个新冠抗原试剂,一个准确率87.17%,另一个是86.63%,这样的准确率显然不能大规模使用,也不能作为主要检测手段使用。不过,在我国企业生产的获CE准入和出口白名单的新冠抗原试剂中,有多款新冠抗原试剂说明书显示准确率超过96%,较雅培、罗氏等国际巨头同类产品的准确率更高。但因为国内病例少导致临床试验困难,这些试剂国内注册推进缓慢。
基于此,为应对冬季严峻的疫情,建议卫健部门研究论证综合检测的可行性,建议药监部门提高准确率高的新型试剂上市的效率。
国内首个基因编辑疗法获批临床
在新发布周期内,来自博雅辑因、康方生物、恒瑞医药、石药集团等的创新药获批临床,我们将其纳入了“人民金融·创新药指数”,多个品种具有较高的创新性。
1月19日,博雅辑因针对输血依赖型β地中海贫血的CRISPR/Cas9基因编辑疗法产品ET-01的临床试验申请获批准,成为国内首个获国家药监局批准开展临床试验的基因编辑疗法产品和造血干细胞产品。
博雅辑因网站称,ET-01是一款处于研发阶段的、自体的、体外基因编辑疗法产品,此次获批开展的临床试验是一项多中心、开放的、单臂临床研究,该项研究将在输血依赖型β地中海贫血患者中评价ET-01单次移植的安全性和有效性。在中国,中重型地中海贫血病患者达30万人,输血依赖型β地中海贫血患者仍有巨大的未被满足的医疗需求。
基因编辑被认为是生命医学领域一项革命性的技术,未来将有可能帮人类大规模消除疾病,提高健康水平和延长寿命。近年来,该领域的研究持续火热。2017年,诺华制药推出了首个FDA批准的基因编辑疗法以治疗人体免疫细胞癌变。随后的几年内,FDA逐步批准了多个基于基因编辑的癌症治疗方法。2020年诺贝尔化学奖授予给了两位年轻的女性科学家,表彰他们对基因编辑技术的贡献。
资本市场也对基因编辑技术也给予了厚望。近一年来,基因编辑三巨头CRISPR、Intellia和Editas股价涨幅分别达到225%、134%和450%,三家公司的总市值达到230亿美元。
近日,石药集团附属公司友芝友生物的第三款双抗Y150获得临床试验默示许可。据悉,Y150是首个获批临床的国产CD38/CD3双抗,其临床试验申请在2020年7月获得CDE受理,适应症为多发性骨髓瘤。
Y150是基于友芝友生物独特的YBODY®双抗技术平台研发的新项目,适用于经过常规化疗或CD38单抗治疗后疾病仍然进展的多发性骨髓瘤患者的临床治疗。临床研究表明,相比于CD38单抗产品,Y150具有疗效好、不易产生耐药性、用药剂量小的优点,具有良好的临床前景。此前,友芝友生物的治疗胃癌、乳腺癌的HER2/CD3双抗和治疗晚期癌性腹水EpCAM/CD3双抗2个品种的产品在中国获批该领域首个和第二个临床批件,目前均处于I期临床阶段。
临床试验进展也是推动“人民金融·创新药指数”走高的原因。在新发布周期内,越甲药业的喷雾用YJ001登记启动了治疗糖尿病性周围神经病理性疼痛的Ⅱ期临床试验;亘喜生物靶向CD19的CAR-T疗法GC007g注射液、必贝特的第二代BTK抑制剂ZXBT-1158胶囊等启动了I期临床。