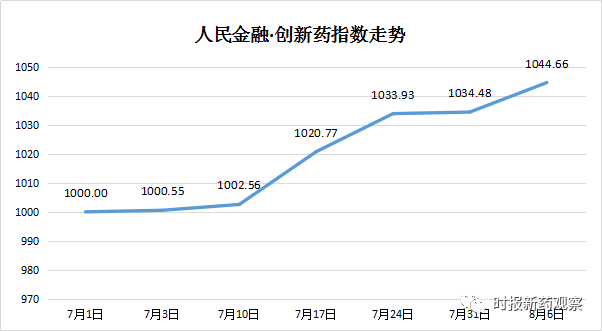
为客观反映中国创新药现状,推动中国创新药发展,证券时报今日发布“人民金融·创新药指数”,指数以2020年7月1日为基日,初始样本包含522个在研创新药,初始样本评价总得分对应基点1000点。
截至7月31日,“人民金融·创新药指数”为1034.48点,较7月1日上涨3.45%,反映出最近我国创新药研发有明显进步。7月份指数走高的原因包括1个创新药获批上市,4个申报上市,17个获批临床,另有多个创新药临床试验状态向前推进。
注射用苯磺酸瑞马唑仑获批上市
7月20日,人福医药的1类新药注射用苯磺酸瑞马唑仑获得国家药监局批准上市。这是“人民金融·创新药指数”成分中首个获批上市的创新药。
注射用苯磺酸瑞马唑仑是由人福医药子公司宜昌人福联合德国PAION公司共同开发的新型苯二氮䓬类药物,为超短效GABAa受体激动剂,此次获批的适应症为结肠镜检查的镇静。资料显示,结直肠癌是我国第三大高发肿瘤疾病,每年发病量39万例,其中内镜筛查是发现肠道肿瘤最有效的方法。太平洋证券预计注射用苯磺酸瑞马唑仑在结肠镜检查领域的销售规模在10亿元左右。
我们注意到注射用苯磺酸瑞马唑仑还在拓展新的适应症,药物临床试验登记与信息公示平台显示,6月11日,宜昌人福新申请了一项III期临床试验,目的是评估注射用苯磺酸瑞马唑仑用于全身麻醉诱导和维持的有效性和安全性,目前试验状态为招募中。
4个创新药申报上市
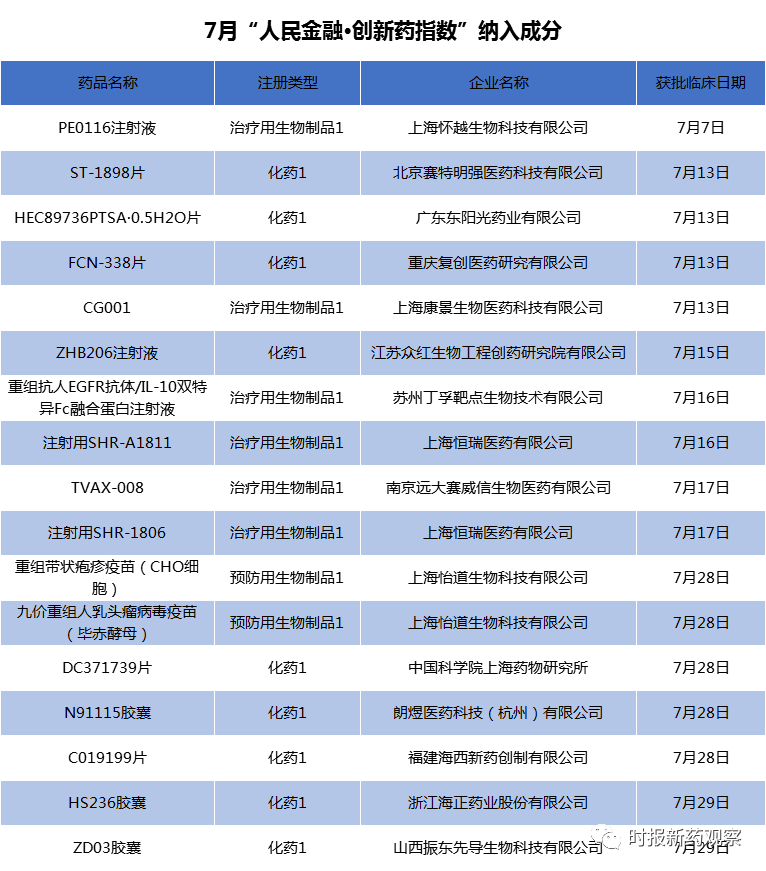
7月份,有4个创新药在上市的路上迈出了关键的一步,华北制药的重组人源抗狂犬病毒单抗注射液、百济神州的帕米帕利胶囊、艾迪药业的ACC007片、河南真实生物的阿兹夫定片的上市申请相继获得国家药品监督管理局的受理。
7月9日,河南真实生物申报的创新药阿兹夫定片上市申请获受理,这是河南真实生物成立以来提交的首个新药上市申请。阿兹夫定是全球首个抗HIV双靶点创新药物,为国内第一个拥有自主知识产权的抗艾滋病毒口服药物,获得国家重大新药创制科技重大专项立项支持,已在中国、美国、欧洲等全球范围申请了专利并获得授权。值得一提的是,阿兹夫定片是以2期临床结果申请上市,去年年中,鉴于2期临床取得的优秀结果,国家药品监督管理局药品审评中心同意阿兹夫定提前申报上市。
重组人源抗狂犬病毒单抗注射液是华北制药的自主创新项目,被列为国家“重大新药创制”科技重大专项品种,目前国内尚无重组抗狂犬病毒单抗药物上市销售。其作用机制及适应症是将本品与狂犬疫苗联用,用以补充狂犬疫苗主动免疫过程中的抗体空白,可直接中和体内狂犬病毒,从而起到被动免疫的作用。该项目最早于2007年6月首次提交临床试验申请,至今历时16年,累计研发投入金额近1.5亿元。8月5日,该品种被国家药监局药审中心拟纳入优先审评品种公示名单,未来有望加速获批上市。
7月17日,帕米帕利胶囊上市申请获NMPA受理,这是百济神州的第三款自主研发的创新药物,适应症为:用于治疗既往接受过至少两线化疗、携有致病或疑似致病的胚系BRCA突变的晚期卵巢癌、输卵管癌或原发性腹膜癌患者。国家药监局网站显示,帕米帕利胶囊已被纳入纳入优先审评品种名单,有望加速获批上市。
ACC007是全新结构的非核苷类逆转录酶抑制剂,为艾迪药业首个抗艾滋病1类新药,被列入国家十三五“重大新药创制”科技重大专项。7月24日,ACC007的上市申请获受理。艾迪药业招股书显示,ACC007的III期临床试验结果良好、到达主要临床终点指标,与目前临床一线治疗方案普遍应用的依非韦伦相比,在安全性、耐受性和依从性方面具有优势。
此外,艾迪药业的复方ACC007片(ACC008片)也是“人民金融·创新药指数”的成分标的。7月底,ACC008片用于治疗经治的HIV-1感染者的临床试验方案,经国家药监局批准可以开展III期临床试验。艾迪药业称,HIV患者每天仅需服用1片,无需再服用其它抗艾滋病药物。ACC008片具有服药负担轻、依从性好、耐药性少等特点,为国内患者提供了一个国际同步的新选择。
17个品种纳入创新药指数
新品种的纳入是“人民金融·创新药指数”走高的主要原因,7月份有17个创新药品种获批临床,我们将其纳入了指数样本,这些品种涉及恒瑞医药、复星医药、千红制药、海正药业、振东制药等上市公司。
恒瑞医药的注射用SHR-1806和注射用SHR-A1811分别于7月16日、7月17日获批临床,两者均属于抗肿瘤药物。
SHR-1806是一种全人源抗肿瘤坏死因子受体超家族成员4(OX40)单克隆抗体。OX40与其配体OX40L属于TNF/TNFR超家族的正性共刺激分子,OX40 /OX40L相互作用在炎性疾病、自身免疫性疾病、肿瘤以及移植免疫的发生、发展中具重要作用。目前,全球尚未有同靶点药物获批上市,罗氏、百时美施贵宝、辉瑞等均有同类药物处于临床早期开发阶段,适应症以晚期恶性肿瘤为主。
SHR-A1811为以HER2为靶点的抗体药物偶联物,拟用于治疗HER2表达或突变的晚期实体瘤。SHR-A1811的同类药物Kadcyla®和Enhertu®2019年销售总额约为14.31亿美元。
复星医药的Bcl-2小分子抑制剂FCN-338片于7月13日获批临床,适应症为血液系统恶性肿瘤。目前,国内尚无Bcl-2靶点的药品上市。2019年,与该新药同靶点的药品全球销售额约为7.49亿美元。
除此之外,创新药指数成分的临床试验进阶也是指数走高的原因之一。7月份,科伦药业的外周κ阿片受体激动剂KL280006注射液登记了一项适应症为急性疼痛的2期临床试验,柯菲平的新一代钾离子竞争性酸阻滞剂创新药盐酸柯诺拉赞片登记了两项3期临床,适应症分别为十二指肠溃疡、反流性食管炎。
“人民金融·创新药指数”编制说明
“人民金融·创新药指数”由证券时报编制,以国内在研创新药为样本,动态追踪样本的审评审批进展、海外申报、增加适应症等进展,目的是客观反映中国创新药现状,推动中国创新药发展。在此,特对指数的编制做个说明。
在我们前期的筹备过程中,反复推敲了创新药评价体系和指数编制方法,多次向创新药核心企业和业内专家征求意见,并组建了“人民金融·创新药指数”编制专家委员会,指导我们的指数编制和创新药评价工作,以使指数能客观、科学反映我国创新药现状。
“人民金融·创新药指数”以2020年7月1日新的《药品注册管理办法》实施之日为基准日,基期指数为1000点。以此为基准日,主要是考虑对创新药的定义与《药品注册管理办法》相一致。即“人民金融·创新药指数”选取的创新药标的与新的《药品注册管理办法》及其细则认定的创新药相一致。
“人民金融·创新药指数”跟踪的创新药,从获批临床开始,到国家药监局作出审评审批结论为止。从创新药获批临床开始跟踪并纳入指数,主要是两方面的考虑,一是获批临床后数据可获取,而临床前研究阶段数据不易获取;二是获批临床说明有了一定的成药性。从结果来看,7月1日有522个在研的创新药符合条件,我们确定为“人民金融·创新药指数”的初始样本。
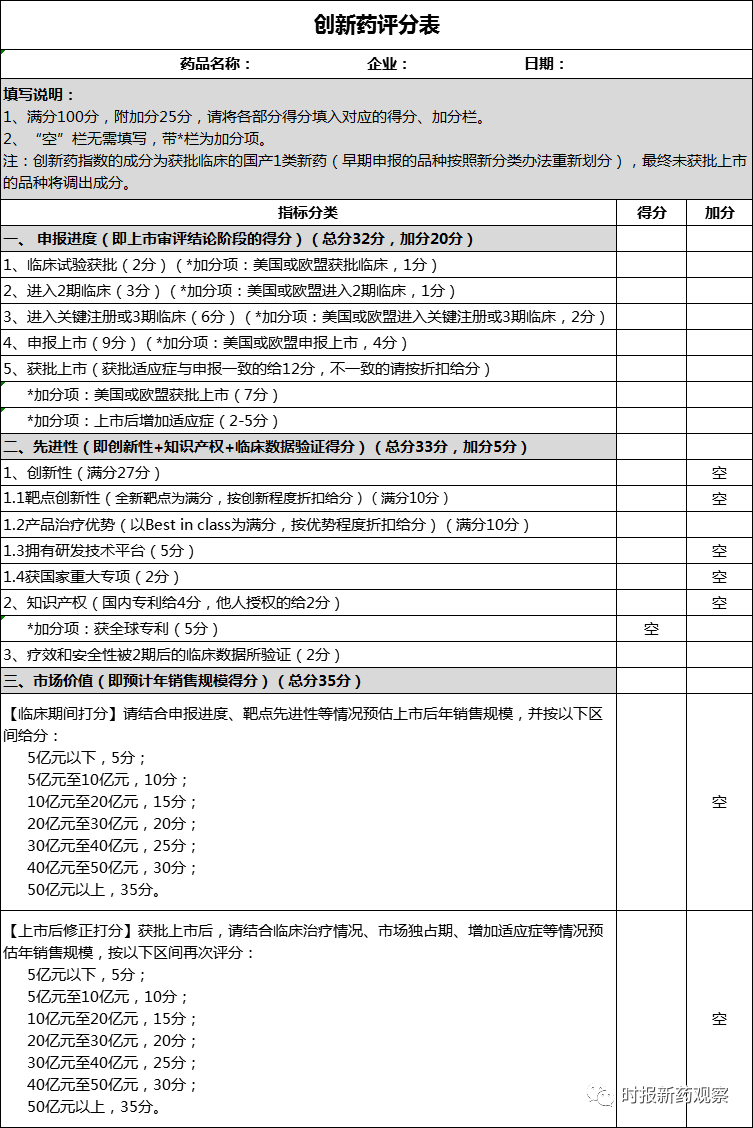
“人民金融·创新药指数”力求对创新药进行相对科学的评价,从审评审批进度、技术先进性、市场价值三个维度进行评价、打分。我们设定的每个创新药的基准分为100分,按三个维度不同的评分标准进行打分。评价和打分以两种形式进行,企业自主打分和指数编制专家委员会打分, 最终的评分以专家委员会为主,自主打分为参考。
三个维度中的申报进度部分,主要考察成药概率。我们选择了临床试验获批、进入2期临床、进入关键注册或3期临床、申报上市、获批上市五个药品审评审批的关键节点进行打分,并依据药物研发的成功率给予了不同权重。在评价体系征求意见中,也有专家和企业提出,应增加药审中心“专家评审会”等新药审评中的重要环节,因这些信息或数据不能公开获取,未采纳。另外,近年来,创新药的同步开发和中美双报、中欧双报明显增加,在申报进度层面,我们对寻求海外市场上市的创新药给予了一定的加分。
先进性部分我们重点评价创新性,该项包括靶点创新性、产品治疗优势等,这两项分别以“First-in-class”和“Best-in-class”为满分,并根据靶点的创新程度、治疗优势程度折扣给分。对于全球专利技术的创新药,我们也给予了一定的加分。
对新药市场价值的评价涉及药物经济学,主观性较强,为使评价尽可能客观,我们综合临床申报进度、靶点先进性、治疗优势等情况预估上市后销售规模。并在国家药监局审评审批结束后, 结合临床治疗情况、市场独占期、增加适应症等情况进行修正。
我们将522个在研创新药设为“人民金融·创新药指数”的初始样本,初始样本的总得分对应基点1000点,新获批临床的创新药,按前述的条件进行评价并纳入指数样本。对于指数成分的评分,我们将根据样本的审评审批进展、海外申报、增加适应症等因子进行动态评价。考虑创新药审评审批周期较长,初期指数波动率可能比较低,初始阶段我们每周公布一次指数。
附:“人民金融·创新药指数”编制专家委员会成员简介
主任委员:柴逸峰,海军军医大学药学系教授,博士生导师, 2009年任第二军医大学药学院院长,2017年任海军军医大学药学系主任。主要从事药学教育、军事药学和药物复杂体系活性分析研究。承担国家重大新药创制专项课题、国家自然科学基金项目等12项课题,曾获得国家科技进步二等奖。先后担任国家人社部全国博士后管委会第七、八届专家组成员,国务院学位委员会第六、七届药学学科评议组成员 。
副主任委员:冯毅,科伦药业研究院首席战略官。曾担任药品审评中心主任助理、国家重大专项办副主任等系列领导职务17年,并在方恩医药担任大中国区总裁、科文顿&柏灵律师事务所担任药品法规事务资深顾问。在药物评估、药物法律法规制定评估方面积累了渊博的知识和丰富的经验。当前领导科伦药业管线委员会负责研究院发展战略制定和产品管线建设,推动公司创新战略的落地实施。
委员:黄钦,医学博士。2002年1月至2018年5月,在药品审评中心从事药品审评工作,历任进口药肿瘤临床、消化适应症临床、预防疫苗临床等主审,生物统计学部负责人等职务。在药审中心工作期间,主审了千余件生产上市和临床试验申请,其中包括数十个国家一类新化合物药,新疫苗和抗肿瘤新生物制品;并负责国家食品药品监督管理局《化学药物临床试验报告的结构和内容技术指导原则》、《药物临床试验生物统计学指导原则》、《临床试验数据管理工作技术指南》、《预防用病毒灭活疫苗研究技术指导原则》和《预防用重组蛋白疫苗研究技术指导原则》等多个法规和技术指南的起草制定工作。现任中国药理学会数学药理专业委员会副主任委员、北京生物医学统计和数据管理研究会副会长和厦门大学兼职教授。
委员:邹建军,博士,江苏恒瑞医药股份有限公司副总经理、首席医学官,毕业于第二军医大学,曾在多家跨国药企担任新药医学开发负责人,目前主要负责恒瑞医药创新药物全球临床研发工作。
委员:王义汉( YIHAN WANG),深圳市塔吉瑞生物医药有限公司创始人、董事长兼总经理。美国纽约大学化学博士,曾在全球生物研发中心——美国波士顿上市公司Ariad Pharma先后担任首席科学家和化学副总监, 主持开发的创新药被广泛应用于生物医药市场,包括国际一类新药IClusigTM (Ponatinib)、AlunbrigTM(Brigatinib)、RidaforolimusTM等。王博士拥有27项抗癌新药的核心专利,曾在国际著名学术杂志发表了60多篇论文。王博士于2007年参与创立了美中生物医药协会CABA,也是全美华人生物医药联盟ALL-CABPA和新英格兰美中医药开发协会(SAPA-NE)的主要发起人之一。
委员:冯辉,医学博士。现任上海君实生物医药科技股份有限公司首席运营官和苏州君盟生物医药科技有限公司总经理。冯辉博士拥有十多年国际生物药品的研发、 生产、 药政及单抗药产业化管理经验,曾在抗体、 融合蛋白及细胞因子的分子构建、 细胞株开发、 工艺研发、 工艺认证、 质量管理以及药政注册方面积累了丰富的工作经验, 曾在国际著名学术期刊累计发表论文十余篇, 并拥有国内外多项发明专利。负责特瑞普利单抗注射(JS001)、抗新冠病毒中和抗体(JS016)等一系列创新单克隆抗体药物的产业化开发与公司运营。冯辉博士毕业于清华大学生物科学本科,获得Albert Einstein College of Medicine 分子药理学博士学位,并完成博士后训练。历任美国拓普艾莱生物技术公司首席运营官、美国阿斯利康公司项目负责人和美国 HumanZyme 公司研究员/项目经理。
委员:蒲江,副研究员,现任安徽智飞龙科马生物制药有限公司总经理。“十一五、十二五、十三五”国家重大传染病专项课题负责人,“十二五、十三五”国家重大药物专项课题负责人,世界卫生组织结核病疫苗会议成员,全球“金砖国家”结核病联盟理事,世界肺部健康联盟(UNION)专家成员。主持完成国家“重大新药创制”科技重大专项3项、 “国家重大传染病防治专项”2项,现承担“国家重大传染病防治专项”3项。现主持重组新型冠状病毒疫苗(CHO细胞)研发。
委员:王如伟,日本国立岛根大学医学博士,教授级高工、博士生导师。第十、十一届国家药典委员会委员。曾任浙江康恩贝制药股份有限公司公司副董事长、总裁。曾任嘉和生物股份有限公司副董事长、总裁。现任泰格医药执行副总裁。获全国优秀科技工作者,享受国务院政府特殊津贴、入选万人计划专家、浙江省新世纪151人才重点层次。国家科技部“重大新药创制专项”、“国际合作专项”、“科技奖励”评委。
