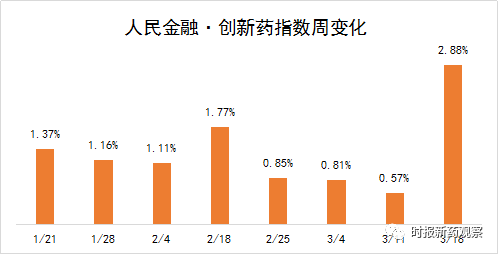
新发布周期内,“人民金融·创新药指数”大涨2.88%,涨幅创历史新高,最新报1481.4点。
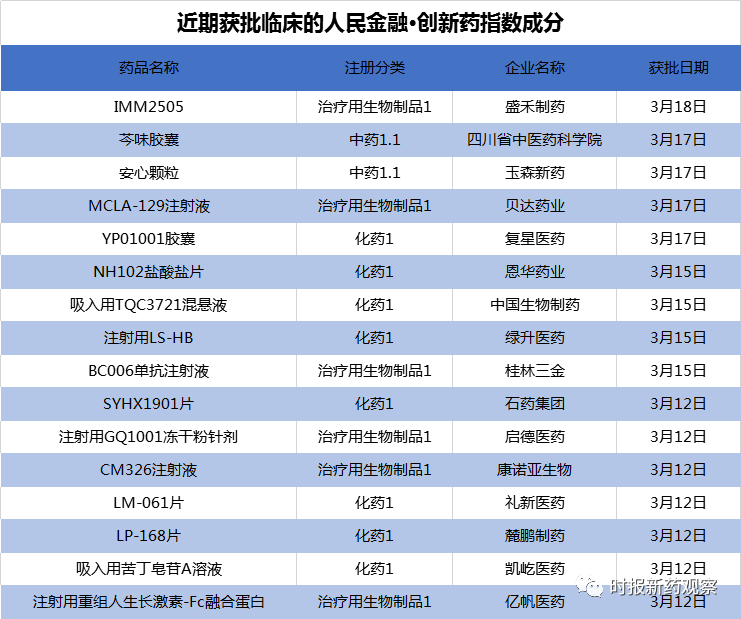
近期我国创新药研发呈强劲增长势头,在3月12日至3月18日的发布周期内,多款药物取得重大进展,我们依据“人民金融·创新药指数”的评分标准,上调了这些创新药审评审批进度的评分。另外,来自贝达药业、复星医药、恩华药业、桂林三金、石药集团等的16个创新药获批临床,一周获批临床的创新药数量也创出历史新高。
创纪录!16个创新药品种获批临床
新发布周期内,首次获批临床的创新药数量大增,包括8个化药、6个生物药、2个中药在内,共16个创新品种取得临床批件,创“人民金融·创新药指数”发布以来新高。
生物大分子药物代表目前国际上最为前沿的药物发展方向。作为我国靶向药的龙头,贝达药业在聚焦小分子药物的同时,也在积极拓展大分子药物研发。近日,贝达药业申报的MCLA-129注射液临床试验申请获得默示许可,这也是贝达药业首个获批临床的抗体新药。
据悉,MCLA-129是一款针对EGFR和c-Met双靶点的双特异性抗体,拟用于EGFR或MET异常的晚期实体瘤患者的治疗。目前,全球尚无靶向c-Met的大分子药物获批上市。在EGFR/c-Met双特异性抗体抗方面,强生集团杨森公司的EGFR/c-Met双特异性抗体Amivantamab于2020年12月分别向美国FDA和欧洲EMA递交了生物制品许可申请和营销授权申请。国内外其它的同靶点类似药物均处于临床前或临床试验阶段,尚无药物上市。
老牌药企桂林三金于2013年收购宝船生物进军生物药,目前有靶向PD-L1和EGFR的两款生物药处于临床试验阶段。近日,宝船生物第三款生物药BC006单抗获批临床。
据宝船生物网站,BC006是一款巨噬细胞集落刺激因子1受体(CSF-1R)抗体,同时也是首个国产CSF-1R抗体,目前在国外针对该靶点的临床在早期阶段。CSF-1R抗体药物的临床批件是宝船生物抗体创新药物研发历程中的里程碑事件。BC006单抗注射液拟用于治疗晚期恶性肿瘤,有望解决在多种实体瘤、血液肿瘤、骨关节疾病等疾病领域未能满足的医疗需求。公司计划尽快开展该分子的临床研究,前期的临床前研究已经取得令人鼓舞的安全性和有效性数据。
3月12日,亿帆医药的1类生物创新药注射用重组人生长激素-Fc融合蛋白(研究代号:F-899)获批临床。据亿帆医药官网3月18日发布的新闻稿,F-899是一个创新型的重组人生长激素二聚体,具有长效的药物作用,为一款重组人生长激素和抗体Fc片段的融合蛋白,首个适应症拟用于治疗儿童生长激素缺乏症,有望成为一种更安全便捷有效的生长激素缺乏症替代疗法。
公司表示,生长激素缺乏症现有产品市场渗透率约10%-12%,预计到2024年有望超过150亿元,CAGR达到20.11%。截至目前,国内上市的重组人生长激素绝大部分为短效,长效重组人生长激素只有深圳科兴药业的赛高路和长春金赛的金赛增;此外,安科生物的长效生长激素已完成临床实验,进入申报阶段;天境生物、维昇药业、特宝生物均已进入临床三期阶段。
同时,盛禾制药的PD-L1/CD47双抗IMM2505、启德医药的ADC药物GQ1001、康诺亚的IL-4R单抗CM326三个1类生物药也于近日获得临床试验默示许可。在1类化药方面,恩华药业、复星医药、石药集团、扬子江等的8个品种获批临床。
3月12日,恩华药业发布了2020年度业绩报告,公司去年实现营收33.61亿元,同期下降18.99%,实现净利润7.29亿元,较上年同期增长9.88%。报告期内,公司加大了研发投入,去年投入科研经费2.46亿元,比2019年增长了30.10%。
2021年,恩华药业创新药有望取得积极进展。年报显示,公司有在研创新药项目有20多项,其中有4项预计在2021年提交中国IND,有2项预计在2021年分别获批中国和美国IND。
3月15日,恩华药业公告其1类化药NH102获批临床,将开展用于抑郁症的临床试验。据公司介绍,NH102是一个多靶点的新型抗抑郁药。临床前试验结果表明,NH102盐酸盐对多个抑郁症模型有效,且对模型动物的性功能障碍有明显的改善作用。截至目前,NH102项目累计已投入研发费用约为1265万元。待药品获批生产,将进一步丰富公司在精神类药品的产品线。
多款创新药取得重大进展
新发布周期内,智飞生物和华昊中天的创新药取得重大进展。
智飞生物重组新冠疫苗被纳入紧急使用,成为国内第四款获批临床紧急使用的新冠病毒疫苗,也是国际上第一个获批临床使用的新冠病毒重组亚单位蛋白疫苗;华昊中天1类新药优替德隆注射液正式获得国家药监局批准上市,意味着中国迎来了首个埃博霉素类抗肿瘤药物。
除此之外,多个创新药品种临床进展取得积极。药物临床试验登记与信息公示平台显示,新发布周期内,石药集团、亚盛医药、康方生物、上海医药等的创新药临床试验状态向前推进。
上海医药于近日登记启动了SPH3127片治疗原发性轻、中度高血压有效性和安全性的多中心、随机、双盲、双模拟、阳性药平行对照的III期临床试验。
SPH3127片是新一代口服非肽类小分子肾素抑制剂,属新作用机制的降压药物。据上海医药微信公众此前发布的消息,SPH3127项目历经多轮次化合物设计、合成、结构优化,药学、非临床研究结果显示,SPH3127在药效、生物利用度和安全窗等方面明显优于同类产品,具备Best-in-class潜质。
近日,石药集团登记启动了“评价ALMB-0168在骨肉瘤患者中的安全性和疗效的Ⅰ/Ⅱ期临床试验”。
ALMB-0168是石药集团自主研发的一款First-in-Class针对半通道膜蛋白Cx43的人源化单克隆抗体激动剂。临床前体外和体内的动物实验显示,ALMB-0168能有效通过激活Cx43蛋白释放抑癌性物质而起到治疗骨癌和癌症骨转移的作用。ALMB-0168用于治疗骨癌的适应症已经获得FDA授予的孤儿药资格认定,并已获批在澳大利亚开展骨癌和癌症骨转移的临床试验。
