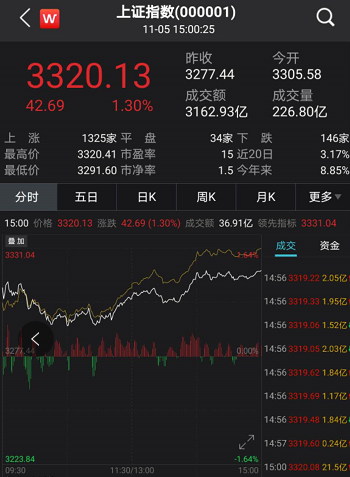
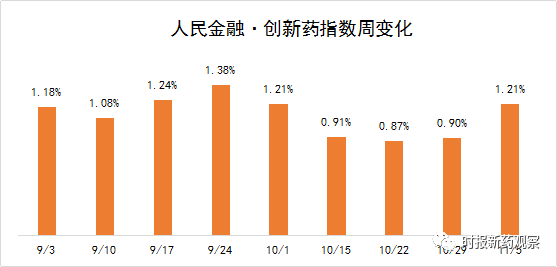
截至11月5日,“人民金融·创新药指数”报1193.39点,在最近一个发布周期内上涨了1.21%,反映出最近我国创新药研发势头良好。
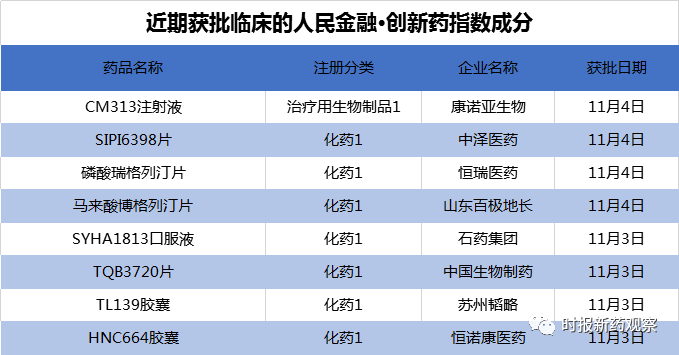
在10月30日至11月5日的发布周期内,来自恒瑞医药、石药集团、中国生物制药等药企的8个创新药获批临床,我们将其纳入了“人民金融·创新药指数”,另外诺诚健华、太景医药等的创新药美国临床取得积极进展。目前,“人民金融·创新药指数”的成分样本数共有628个。
我国新冠检测试剂和疫苗研发取得突破
11月5日,国家药监局发布公告称,应急审批通过万孚生物和金沃夫生物的新冠病毒抗原检测试剂盒。这是我国首次批准新冠病毒抗原检测试剂,意味着新冠抗原检测试剂的研发取得了实质性进展。
早在8月份,在国新办举行的提高新冠病毒检测能力国务院政策例行吹风会上,工信部相关负责人表示,推动抗原检测和其他新技术新产品的研发攻关,进一步丰富检测筛查的技术手段。
首次批准的新冠病毒抗原检测试剂产品检测时间在20分钟之内,在急性感染期病毒载量较高时能够快速检出阳性病例,可以用于对疑似人群进行早期分流和快速管理。
11月3日,英国宣布在利物浦试点以抗原试剂等方式开展首次全民新冠病毒“普测”。同时,利物浦也会对疑似病例配合采用更可靠的核酸测试。英国首相鲍里斯称,这种大规模测试是对抗新冠的强大新武器。在开展这项普测后,当地隔离的时间也将从14天缩短为7天。
同日,德国也宣布每个月购买数百万剂抗原试剂分发给养老院,每个月给每个老人发20剂。实际上,10月份以来,美、英、法、德等国家将抗原试剂作为复工复学,机场、车站等人流密集场所,发热门诊筛查新冠感染者的主要手段。
两个产品获批上市,丰富了新冠病毒检测试剂类型,扩大了新冠病毒检测试剂的供应,进一步服务疫情防控的需要。未来可根据抗原、抗体和核酸三种试剂的检测特点进行联合使用,如用抗原和抗体试剂对机场、车站等密集人流,以及高危人群快速检测,在发现疑似病例再以核酸等手段核检,以提高防控效率和经济活力。
除了新型检测技术,近日我国多个新冠疫苗研发也取得积极进展。
11月2日,美莱德重组新型冠状病毒疫苗项目组赴乌兹别克斯坦考察启动仪式在泊联汇酒店隆重举行。美莱德为智飞生物重组新冠疫苗临床试验的执行团队,照此看,智飞生物的新冠疫苗即将启动三期临床。
三叶草生物的新冠疫苗也同属重组蛋白路线,公司表示,可在今年年底前进入全球范围II/III期有效性研究。近日,流行病防范创新联盟(CEPI)宣布扩大与三叶草生物的合作,资助其新冠疫苗全球II/III期研究以获取上市许可,CEPI对三叶草生物的总资助将高达3.28亿美元。
此外,复星医药和BioNTech合作开发mRNA新冠肺炎疫苗也临近Ⅱ期临床。在第三届进博会上,复星医药透露,该疫苗国内Ⅰ期临床试验进入了数据分析阶段,临床Ⅱ期桥接试验积极筹备中。远大医药11月3日晚间发布公告称,其新冠DNA疫苗在美国获批启动I期临床试验。
8个创新药获批临床
截至11月5日,“人民金融·创新药指数”报1193.39点,在最近一个发布周期内上涨了1.21%。在10月30日至11月5日的发布周期内,来自恒瑞医药、石药集团、中国生物制药等药企的8个创新药获批临床,我们将其纳入了“人民金融·创新药指数”。目前,“人民金融·创新药指数”的成分样本数共有628个。
恒瑞医药的磷酸瑞格列汀片已于9月底提交上市申请并获受理,近日新获批临床试验。该药属于DPP-4抑制剂,DPP-4抑制剂是降糖药领域的重磅品类。目前,国内共5款DPP-4抑制剂获批上市,均为外企研发,且国内均有仿制药获批,仿制药共涉及近20家企业。除磷酸瑞格列汀片外,进入临床的DPP-4抑制剂新药还有石药集团的DBPR108、中国生物制药的TQ05510、海思科的HSK7653片等。可以想象DPP-4抑制剂未来的竞争将会异常激烈。
11月3日,恒诺康医药的HNC664胶囊获批临床,适应症为特发性肺纤维化。除了HNC664胶囊,恒诺康医药还在与珍宝岛合作开发抗流感药创新药注射用HNC042。这两款创新药正在美国开展开展临床试验。据悉,HNC664为一种新型的ATX抑制剂,在抑制ATX活性和药物代谢等方面均较GLPG1690有显著提高,有望成为一个具有市场竞争力的新型抗特发性肺纤维化药物。纤维化领域存在巨大的未满足的临床需求,目前全球范围内尚缺乏有效治疗纤维化药物。在“人民金融·创新药指数”的成分中,除恒诺康医药的HNC664外,中国生物制药、众生药业、东阳光等也有治疗纤维化的创新药。
诺诚健华等的创新药获批美国临床
国内的创新药研发竞争激烈,且患者支付能力有限,为将药物分子的商业价值最大化,不少创新药企业将目光投向国际市场。开拓国际市场很重要的一个途径是开展以境外注册为目的的临床研究,近年来在中美两地同时获得临床研究许可的企业数量不断增加。
在“人民金融·创新药指数”的成分中,包括来自恒瑞医药、亿帆医药、信立泰、康方生物等逾30家企业的中美双报品种。近期,有多个创新药获美国FDA批准开展临床试验。
诺诚健华的BTK抑制剂奥布替尼目前有两个适应症申报上市,目前分别完成了注册生产现场检查和临床试验数据现场核查,均有望于明年一季度获批上市。
近日,奥布替尼用于治疗多发性硬化症(MS)的临床申请获美国FDA批准,将于近期在美国开展临床II期研究。该试验为国际多中心临床II期研究,将于美国和多个欧洲国家开展,计划招募160名患者。MS目前尚无法治愈,药物多以控制病情进展为主要目标,存在高度未满足的医疗需求。
药物临床试验登记平台显示,今年7月太景医药在我国启动了其抗流感新药TG-1000的I期临床研究,目前已入组4人。11月2日,太景医药称,TG-1000已通过美国FDA审查,核准进行临床试验。TG-1000为帽依赖性核酸内切酶抑制剂,作用于病毒复制过程必须的抢帽机制,可有效阻断病毒复制与传播,能够有效对抗甲型流感、乙型流感、H7N9禽流感和达菲耐药病毒。临床前试验结果显示,TG-1000与巴洛沙韦效果相当,具有一个用药疗程仅需服药一次的潜质。
康方生物的AK112为全球首个进入临床阶段的PD-1/VEGF双特异性抗体,去年7月获得美国FDA临床试验许可。近日,康方生物在2020中国肿瘤免疫治疗会议上发布了AK112的Ia期临床研究阶段性数据,公司公告称,最初剂量递增阶段的临床研究结果令人鼓舞。